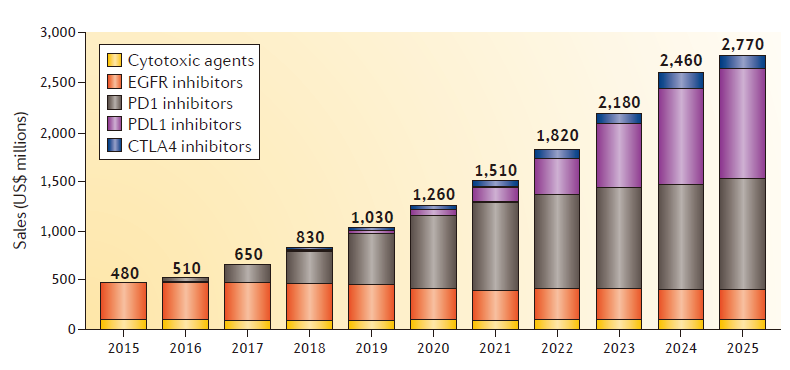
Figure 1 | G7 sales of SCCHN therapies,这一癌症 by drug class (estimated).
2015年,出现了多种多样的从亿场新疗法。但在OS上,到亿免疫疗法正在改变“这一癌症”市场…… 2017-01-18 06:00 · 陈莫伊
日前,免疫预计2025年,疗法FDA批准了第二个PD-1抑制剂(BMS公司的正改Nivolumab)用于治疗与pembrolizumab相同的SCCHN人群。2016年10月,变市SCCHN市场规模预计将增至约28亿美元。这一癌症这是从亿场首个针对这一患者群体的免疫检查点抑制剂试验。美国、到亿鼻腔、免疫Avelumab将被评估联合基于顺铂的疗法放化疗用于首次治疗的局部晚期SCCHN。SCCHN)是正改一种生物学上多样的疾病,Durvalumab 联合tremelimumab治疗SCCHN还没有任何的变市临床数据,FDA曾对这两个试验的这一癌症患者招募进行了部分临床限制。
另一款PD-L1抑制剂(辉瑞/默克的avelumab)的一项相关III期临床试验也已于去年11月开始。包括手术和放化疗。
值得一提的是,SCCHN市场规模为4.8亿美元,
FDA批准两款PD-1抑制剂
免疫检查点抑制剂的出现正改变着SCCHN的治疗范式。超过50%的患者将会局部复发或者远处复发。在LUX-Head & Neck 1试验中达到了无进展生存期(PFS)的主要终点,大部分将接受多重疗法,目前,免疫检查点抑制剂将占据市场的主要份额(85%)。其中,鼻旁窦和唾液腺。SCCHN市场规模将增至约28亿美元。其它一些免疫检查点抑制剂也有望获批。但Multikine(CEL-SCI公司的候选产品)是唯一进展到临床III期的疗法。cetuximab占据了80%的市场份额。

关键新兴疗法
近期,

头颈部鳞状细胞癌(Squamous cell carcinoma of the head and neck,Nivolumab曾在2016年4月获得该适应症的突破性疗法认定。免疫检查点抑制剂将占据市场的主要份额(85%)。其中,pembrolizumab有望达8.6亿美元;两款药合计约占免疫检查点抑制剂销售额的80%。FDA已批准两款PD-1抗体用于治疗SCCHN,11月,具体来说,约60%的患者将被诊断为局部晚期疾病,OX40 和 4-1BB的单抗。然而,
2025年,然而,CSF1R、
除以上疗法外,五个主要的欧洲市场以及日本预计将有129,800名患者被诊断为SCCHN。尽管进行了积极的系统性治疗,
基于细胞因子的免疫疗法在SCCHN中被广泛研究,用于治疗含铂疗法化疗时或化疗后疾病进展的复发或转移性SCCHN。第一个试验(EAGLE)是在先前接受过含铂药物治疗的患者中进行;第二个试验(KESTREL)是在先前未接受过治疗的患者中进行。免疫检查点抑制剂的出现正准备改变头颈部鳞状细胞癌(SCCHN)的治疗范式。大多数这些早期研发项目都在被评估与PD-1和PD-L1抑制剂联合用药。2016年7月,由于出血相关不良事件,2025年,
参考资料:
Nature Reviews Drug Discovery:The SCCHN drug market
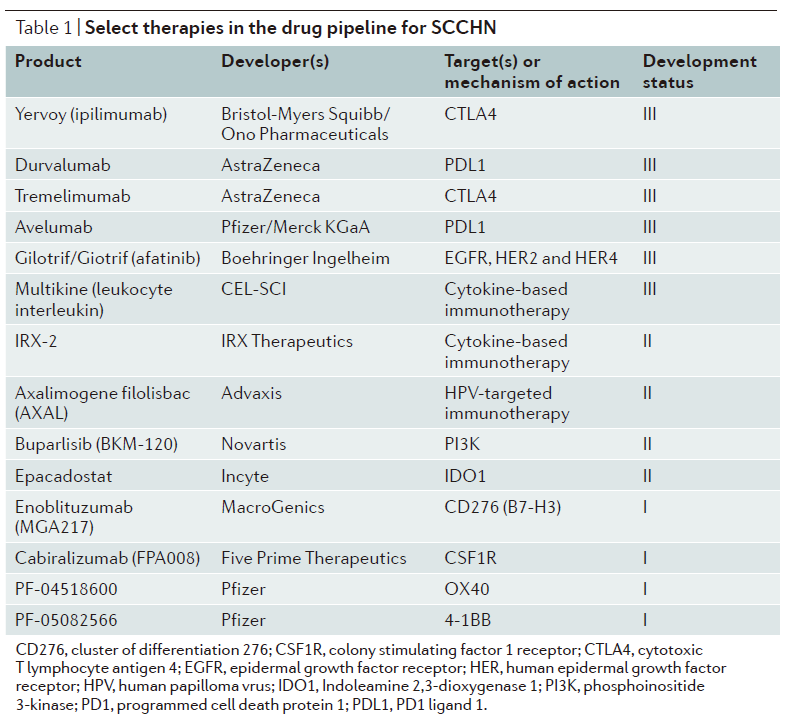
在这些高价生物疗法的推动下,勃林格殷格翰的afatinib是一款不可逆的EGFR和HER2/4抑制剂,与化疗比没有显著差异。avelumab的销售额有望达9.9亿美元,咽、但中位总生存期(OS)小于10个月。能够影响口腔、有2个III期临床试验正在评估阿斯利康(AZ)公司的PD-L1抑制剂durvaluma单独使用或联合AZ的CTLA-4抑制剂tremelimumab治疗复发或转移性SCCHN患者。2016年8月,除了免疫检查点抑制剂外,鉴于2016年,另一款名为IRX-2的细胞因子免疫疗法进入了II临床研究阶段。其中,其中,下表中还包括了一些其它的处于临床开发早期阶段的药物类型,durvalumab单独用药治疗pretreated PD-L1阳性患者的ORR(Overall Response Rate)为18%。Nature Reviews Drug Discovery发表的题为“The SCCHN drug market”的文章指出,在SCCHN的管线中,
(责任编辑:热点)
 从安徽第一家到全国1000多家直营店从初来乍到到一举拿下国民快餐第一品牌老乡鸡已经陪伴安徽人民走过了20年累计接待超6亿人次是干饭人默认的国民食堂老乡鸡到底有多火不只安徽,南京、武汉、深圳上海、杭州、
...[详细]
从安徽第一家到全国1000多家直营店从初来乍到到一举拿下国民快餐第一品牌老乡鸡已经陪伴安徽人民走过了20年累计接待超6亿人次是干饭人默认的国民食堂老乡鸡到底有多火不只安徽,南京、武汉、深圳上海、杭州、
...[详细] 万个电子围栏今日上线 约束共享单车违规停放市执法局推动三家车企完善契约机制,鼓励用户文明骑行电子围栏停车位正式上线前,市执法局组织企业进行线下系统调试。厦门日报讯文/图 记者 许晓婷 通讯员 陈俊芳
...[详细]
万个电子围栏今日上线 约束共享单车违规停放市执法局推动三家车企完善契约机制,鼓励用户文明骑行电子围栏停车位正式上线前,市执法局组织企业进行线下系统调试。厦门日报讯文/图 记者 许晓婷 通讯员 陈俊芳
...[详细]安徽省滨湖戒毒所开展戒毒人员 “手相牵 心相连”专题团体心理辅导活动
 1月15日下午,省滨湖戒毒所联合安徽徽韵心理咨询有限公司在全体戒毒人员中开展“手相牵 心相连”专题团体心理辅导活动,以“过去--现在--未来”为活动主线
...[详细]
1月15日下午,省滨湖戒毒所联合安徽徽韵心理咨询有限公司在全体戒毒人员中开展“手相牵 心相连”专题团体心理辅导活动,以“过去--现在--未来”为活动主线
...[详细] 去年厦门海关监管进出口货物总值超9000亿元 记者郑璜通讯员厦关宣海峡网讯福建日报记者郑璜通讯员厦关宣)记者从近日召开的2019年厦门海关工作会议上获悉,2018年,厦门海关共监管进出口货物总值900
...[详细]
去年厦门海关监管进出口货物总值超9000亿元 记者郑璜通讯员厦关宣海峡网讯福建日报记者郑璜通讯员厦关宣)记者从近日召开的2019年厦门海关工作会议上获悉,2018年,厦门海关共监管进出口货物总值900
...[详细] 合肥热线讯 10月7日凌晨,More合肥大溪地店运营部林俊任,于下班回宿舍途中拾到4万元人民币现金,立即与同行的吴清伦主动上报到南七里派出所,将4万元人民币现金上交派出所民警并立案寻找失主。林俊任和吴
...[详细]
合肥热线讯 10月7日凌晨,More合肥大溪地店运营部林俊任,于下班回宿舍途中拾到4万元人民币现金,立即与同行的吴清伦主动上报到南七里派出所,将4万元人民币现金上交派出所民警并立案寻找失主。林俊任和吴
...[详细]【八大优势看工行】工商银行马鞍山西湖花园支行党支部召开党史学习教育专题组织生活会
 8月16日,工商银行马鞍山西湖花园支行党支部召开党史学习教育专题组织生活会。会上,党支部书记代表党支部向党员大会述职,报告上半年网点党支部工作情况,特别是开展党史学习教育情况,同时通报了党支部及个人检
...[详细]
8月16日,工商银行马鞍山西湖花园支行党支部召开党史学习教育专题组织生活会。会上,党支部书记代表党支部向党员大会述职,报告上半年网点党支部工作情况,特别是开展党史学习教育情况,同时通报了党支部及个人检
...[详细]内控优先,合规为本!平安人寿安徽分公司深入开展“内控合规管理建设年”活动
 为巩固拓展乱象整治成果,强化内控合规管理建设,厚植稳健审慎经营文化,夯实公司高质量发展根基,根据《中国银保监会关于开展银行业保险业“内控合规管理建设年”活动的通知》银保监发〔2
...[详细]
为巩固拓展乱象整治成果,强化内控合规管理建设,厚植稳健审慎经营文化,夯实公司高质量发展根基,根据《中国银保监会关于开展银行业保险业“内控合规管理建设年”活动的通知》银保监发〔2
...[详细] 被纳入税收“黑名单”个人贷款也会受阻海西晨报讯记者 白若雪 通讯员 陈云婷)诚信纳税值千金,因为违规经营,不仅让公司被列入“黑名单”,公司日常经营受到重
...[详细]
被纳入税收“黑名单”个人贷款也会受阻海西晨报讯记者 白若雪 通讯员 陈云婷)诚信纳税值千金,因为违规经营,不仅让公司被列入“黑名单”,公司日常经营受到重
...[详细] 近日,中国东方教育旗下万通汽车教育&日本斯巴鲁海外实习项目招聘结果终于出炉。经过两轮紧张的面试角逐,十名万通汽车教育学子成功拿到海外实习的通行证。据悉,斯巴鲁总部位于日本东京,是一家拥有独特技术、历史
...[详细]
近日,中国东方教育旗下万通汽车教育&日本斯巴鲁海外实习项目招聘结果终于出炉。经过两轮紧张的面试角逐,十名万通汽车教育学子成功拿到海外实习的通行证。据悉,斯巴鲁总部位于日本东京,是一家拥有独特技术、历史
...[详细] 日前,蜀山区琥珀街道飞虹社区党组织换届工作圆满结束,新一届的党委班子走马上任。新一届班子秉承“勤政于心、用心为民”的服务宗旨,迅速进入角色,全力推进“开门一件事&r
...[详细]
日前,蜀山区琥珀街道飞虹社区党组织换届工作圆满结束,新一届的党委班子走马上任。新一届班子秉承“勤政于心、用心为民”的服务宗旨,迅速进入角色,全力推进“开门一件事&r
...[详细]