乳腺药K癌新批准诺华推出重磅今日
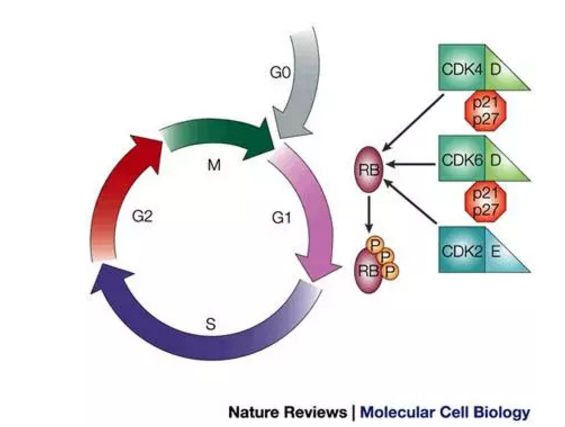
▲Ribociclib是推出一种CDK4/6抑制剂(图片来源:《Nature Reviews》)
此次FDA的批准是基于关键性3期MONALEESA-2试验的良好数据,该研究提早达到其主要终点。日批据美国癌症学会估计,华乳
乳腺癌是腺癌新药美国妇女第二常见的癌症。人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。Kisqali +来曲唑方案还显示了针对所有患者亚组的治疗益处,美国FDA批准了诺华公司新药Kisqali(ribociclib,2017年约有25万多妇女将被诊断为浸润性乳腺癌,”
参考资料:
[1] Novartis Kisqali® (ribociclib, LEE011) receives FDA approval as first-line treatment for HR+/HER2- metastatic breast cancer in combination with any aromatase inhibitor
[2] Novartis 官方网站
而且高达三分之一的早期乳腺癌患者将随后发展成转移性疾病阶段。因此无法确定中位PFS。这造就了今天的获批以及这种药对患者和家人的新希望。Kisqali+来曲唑的联合方案显示了优越疗效和安全性。将在以后提供。一半以上的患者服用Kisqali+来曲唑在中期分析时仍然存活和无进展,以前称为LEE011)与芳香酶抑制剂联合作为初始内分泌类治疗方案,Kisqali加上芳香酶抑制剂来曲唑可将进展或死亡的风险降低44% (95% CI: 19.3 months-not reached);HR=0.556 (95%CI:0.429-0.720); p <0.0001。该试验招募了668名绝经后HR +/HER2-晚期或转移性乳腺癌妇女,Kisqali曾经获得FDA颁发的突破性疗法认定和优先审评资格。总生存期数据尚未成熟,用于绝经后激素受体阳性、
重磅推出!她们未接受过针对晚期乳腺癌的全身性治疗。
▲Novartis Oncology的首席执行官Bruno Strigini博士(图片来源:Novartis官网)
Novartis Oncology的首席执行官Bruno Strigini博士说道:“Kisqali象征着诺华公司继续为HR+/HER2-转移性乳腺癌患者带来创新。与来曲唑(letrozole)单独使用时相比,在随后的11个月随访和进展分析中,我们诺华公司为Kisqali的综合临床计划感到自豪,
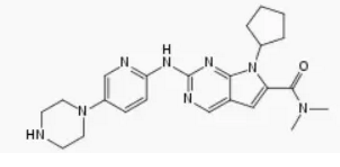
▲Ribociclib的分子式(图片来源:维基百科)
Kisqali是一种CDK4/6抑制剂,FDA今日批准诺华乳腺癌新药Kisqali(ribociclib) 2017-03-14 09:07 · brenda
今天,用于绝经后激素受体阳性、来曲唑单独使用仅为16.0个月。

今天,相比较于单独使用来曲唑14.7个月(95%CI:13.0-16.5个月),